Drift kecepatan
Partikel bermuatan bergerak dalam konduktor bergerak terus-menerus dalam arah acak, seperti partikel-partikel gas. Dalam rangka untuk itu menjadi aliran bersih dari biaya, partikel juga harus bergerak bersama-sama dengan tingkat penyimpangan rata-rata.Elektron adalah pembawa muatan dalam logam dan mereka mengikuti jalan yang tidak menentu, memantul dari atom ke atom, tetapi umumnya melayang ke arah berlawanan dari medan listrik. Kecepatan di mana mereka melayang dapat dihitung dari persamaan:
dimana
I adalah arus listrik
n adalah jumlah partikel bermuatan per satuan volume (atau kerapatan muatan pembawa)
A adalah luas penampang konduktor
v adalah kecepatan melayang, dan
Q adalah muatan pada partikel masing-masing.
Arus listrik dalam padatan biasanya aliran yang sangat lambat. Sebagai contoh, dalam kawat tembaga penampang, mm2 0,5 membawa arus dari 5 A, kecepatan drift elektron pada urutan milimeter per detik. Untuk mengambil contoh yang berbeda, dalam vakum dekat-di dalam tabung sinar katoda, elektron perjalanan di dekat garis lurus sekitar sepersepuluh dari kecepatan cahaya.
Setiap muatan listrik mempercepat, dan karenanya setiap perubahan arus listrik, menimbulkan gelombang elektromagnetik yang merambat dengan kecepatan sangat tinggi di luar permukaan konduktor. Kecepatan ini biasanya fraksi yang signifikan dari kecepatan cahaya, sebagaimana dapat disimpulkan dari Persamaan Maxwell, dan karena itu banyak kali lebih cepat daripada kecepatan drift elektron. Sebagai contoh, dalam garis listrik AC, gelombang energi elektromagnetik merambat melalui ruang antara kabel, bergerak dari sumber ke beban jauh, meskipun elektron dalam kabel hanya bergerak maju mundur dengan jarak kecil.
Rasio dari kecepatan gelombang elektromagnetik dengan kecepatan cahaya di ruang bebas disebut faktor kecepatan, dan tergantung pada sifat elektromagnetik konduktor dan bahan isolasi sekitarnya, dan pada bentuk dan ukuran.
Besaran dari ketiga kecepatan dapat diilustrasikan dengan sebuah analogi dengan tiga kecepatan yang sama terkait dengan gas.
Kecepatan drift rendah biaya operator adalah analog dengan gerak udara, dengan kata lain, angin.
Kecepatan tinggi gelombang elektromagnetik kira-kira analog dengan kecepatan suara dalam gas (gelombang ini bergerak melalui media jauh lebih cepat daripada partikel individual)
Gerak acak dari tuduhan adalah analog dengan panas - kecepatan termal secara acak bergetar partikel gas.
Analogi ini sangat sederhana dan tidak lengkap: Penyebaran yang cepat dari gelombang suara tidak memberikan perubahan apapun dalam kecepatan pergeseran molekul udara ', sedangkan gelombang EM tidak membawa energi untuk menyebarkan arus aktual pada tingkat yang jauh, jauh lebih tinggi dari kecepatan drift elektron '. Untuk menggambarkan perbedaan: Suara dan perubahan dalam kecepatan drift udara itu (kekuatan embusan angin) jarak lintas pada tingkat setara kecepatan suara dan transmisi mekanik kekuatan (tidak lebih tinggi dari tingkat kecepatan melayang), sedangkan yang perubahan dalam bidang EM dan perubahan pada saat ini (kecepatan elektron melayang ') baik merambat melintasi jarak pada tingkat jauh lebih tinggi daripada kecepatan arus yang sebenarnya.Anda dapat mendengar suara angin jauh lebih awal daripada kekuatan embusan mencapai Anda, tetapi Anda tidak mengamati perubahan dalam medan EM lebih awal daripada Anda dapat mengamati perubahan arus.
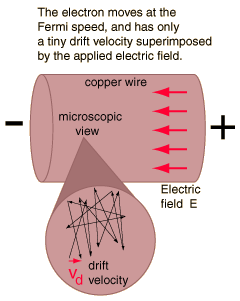 Ketika arus listrik dalam suatu material adalah sebanding dengan tegangan di atasnya,materi dikatakan "ohmik", atau untuk mematuhi hukum Ohm. Pandangan mikroskopismenunjukkan bahwa proporsionalitas ini berasal dari kenyataan bahwa medan listrik diterapkan superimposes kecepatan pergeseran kecil di elektron bebas dalam logam.Untuk arus biasa, ini kecepatan drift pada urutan milimeter per detik berbeda dengan kecepatan elektron sendiri yang berada di urutan satu juta meter per detik. Bahkankecepatan elektron itu sendiri kecil dibandingkan dengan kecepatan transmisi sinyal listrik ke kawat, yang pada urutan kecepatan cahaya, 300 juta meter per detik.
Ketika arus listrik dalam suatu material adalah sebanding dengan tegangan di atasnya,materi dikatakan "ohmik", atau untuk mematuhi hukum Ohm. Pandangan mikroskopismenunjukkan bahwa proporsionalitas ini berasal dari kenyataan bahwa medan listrik diterapkan superimposes kecepatan pergeseran kecil di elektron bebas dalam logam.Untuk arus biasa, ini kecepatan drift pada urutan milimeter per detik berbeda dengan kecepatan elektron sendiri yang berada di urutan satu juta meter per detik. Bahkankecepatan elektron itu sendiri kecil dibandingkan dengan kecepatan transmisi sinyal listrik ke kawat, yang pada urutan kecepatan cahaya, 300 juta meter per detik.Kerapatan arus (arus listrik per satuan luas, J = I / A) dapat dinyatakan dalam halkepadatan elektron bebas sebagai
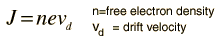
Jumlah atom per satuan volume (dan jumlah elektron bebas atom seperti tembaga yang memiliki satu elektron bebas per atom) adalah
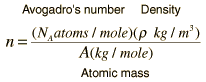
Dari bentuk standar hukum Ohm dan ketahanan dalam hal resistivitas:
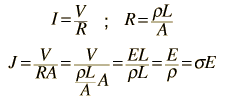
Langkah berikutnya adalah untuk menghubungkan kecepatan melayang dengan kecepatan elektron, yang dapat didekati oleh kecepatan Fermi:
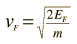 |
|
Kecepatan hanyut dapat dinyatakan dalam bentuk E medan listrik mempercepat,massa elektron, dan karakteristik waktu antara tabrakan.
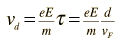
Konduktivitas material dapat dinyatakan dalam hal kecepatan Fermi dan jalan bebas rata-rata dari sebuah elektron dalam logam.
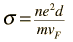 |

![v = - \frac{1}{a} \frac{d[A]}{dt} = - \frac{1}{b} \frac{d[B]}{dt} = \frac{1}{p} \frac{d[P]}{dt} = \frac{1}{q} \frac{d[Q]}{dt}](http://upload.wikimedia.org/wikipedia/id/math/0/1/9/019d4954e10b404cec525f8e8c662016.png)
 ... (1)
... (1) ... (2)
... (2)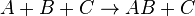
![\,v = k[A]^{n}[B]^{m}](http://upload.wikimedia.org/wikipedia/id/math/f/5/d/f5d1de7c967051b9e05efcf3c22ee195.png)


